牛皮肤癣新药2024年?在皮肤科领域,我国自主研发的首创新药——本维莫德乳膏2024年在美国获批上市,而我国整整领先三年,真正做到了全球首创,本维莫德的研发真正做到了领跑国际可以说,本维莫德乳膏是中国创新药出海的一个成功典范。
”3月19日,在“全球视野下中国皮肤科新药研发与创新高峰论坛”上,清华大学首席研究员孔繁圃指出,从创新药审批通过数量来看,我国与美国的差距正在迅速缩小。
以2024年为例,我国审批通过47个创新药,美国FDA审批通过50个创新药。
不过我们也要清醒地认识到,与制药强国相比,我们仍有较大差距,未来还要付出加倍的努力。
清华大学首席研究员孔繁圃在全球视野下中国皮肤科新药研发与创新高峰论坛上发言。
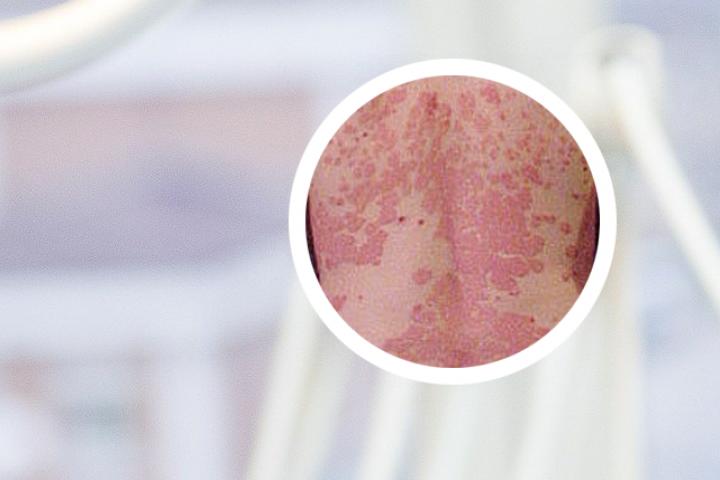
主办方供图这款治疗银屑病的创新药,中国上市后3年美国才上市“皮肤病的种类很多,多达2000种。
但是最常见的皮肤病大概就是10多种,其余的虽然有名字,但是非常少见。
近年来,我国在皮肤病的治疗上不断实现突破,最标志性的进展莫过于银屑病。
“银屑病俗称‘牛皮癣’,中医有句古话,‘内不治喘,外不治癣’,主要是说这两种病难医治疗。
”张建中称,“外不治癣”的这个帽子,我们戴了几百年之久。
最近10年,随着本维莫德乳膏等疗效高且安全性好的药物相继问世,我们治愈了大量的顽固性皮肤病的患者。
“这款治疗银屑病的创新药,中国上市后3年美国才上市。
”张建中表示,从2009年获批临床试验到2024年获批上市,本维莫德乳膏成功的背后凝聚了太多人的汗水与努力。
“2024年,我开出中国第一张本维莫德乳膏的处方,那种激动无法用语言来形容。
”对于这款中国本土全球首创新药,国际银屑病学会主席曾给出这样的评价,“自1980年以来,国际上银屑病外用药研发一直没有突破,本维莫德的研发成功是30多年来银屑病治疗领域的突破性进展。
” 关于本维莫德的治病机理,AhR靶点创新药本维莫德主要发明人、上海泽德曼医药科技有限公司CEO陈庚辉博士介绍,本维莫德是一种小分子药物,属于非激素类、治疗性芳香烃受体(AhR) 激动剂,可以从多个途径阻断银屑病的发病环节。
“从临床数据上看,AhR调节剂治疗炎症性皮肤病临床优势明显。
”陈庚辉还提到,AhR在人体多种组织中均有表达,尤其在表皮和粘膜组织上表达广泛,被誉为“超级靶点”,潜在的相关治疗疾病领域多,其团队未来也将致力于AhR在其他疾病领域的研究。
遵循科学标准,多方合力加快皮肤创新药研发上市,“让创新药、好药早日惠及百姓。
”国家药品监督管理局药品审评中心化药药学一部部长王亚敏介绍,这句话,药学一部的每位同事一进办公室就能看到,也希望能够时时提醒大家,我们要加速完善标准体系建设,通过起草指导原则提高药品审评的质量和效率。
3月19日,全球视野下中国皮肤科新药研发与创新高峰论坛期间,专家学者在“科学监管赋能创新药出海”沙龙研讨环节分享交流。
主办方供图王亚敏举例称,本维莫德乳膏专业审评过程中,审评人员曾多次与研发团队进行沟通交流,希望能够尽可能加快创新药的研发上市进程。
“我们坚持鼓励以临床价值为导向的新药好药、罕见病用药等临床急需药品研发创新,促进创新药高质量发展。
”无独有偶,药品审评中心化药临床二部作为主审报告部门,在本维莫德乳膏的临床研发过程中,曾多次主持与研发团队开展多种形式的沟通交流,有效鼓励和促进了该药的创新研发进程。
“2009年,本维莫德乳膏获批临床试验。
2010年1月的一个周三咨询日,我们第一次与研发团队负责人对接,随后的10年间,每当临床研发的关键节点,我们都通过沟通交流为研发企业提供具体的技术指导性意见和建议,帮助企业进行临床试验科学设计,为本维莫德的成功研发上市提供了有益支持。
在这个过程中,有记载的审评团队与研发企业的沟通交流会议曾有9次。
为充分评价该药的安全性和有效性,我们还主持召开过2次大规模的多学科领域专家参加的专家咨询会,1次在批准其开展临床试验前,1次在批准上市前。
”国家药品监督管理局药品审评中心化药临床二部部长谢松梅回忆。
陈庚辉回忆到,在本维莫德的审评审批过程中,除了有记录的沟通会议,研发人员、研究者和药审中心进行了不计其数次的沟通交流,药审中心对整个研发给予非常多的提醒、指导,以免企业走弯路,加速了药物研发的进程。
作为本维莫德临床试验负责人,张建中主任感叹到,在整个临床研发过程中,药审中心始终为患者着想,为科学着想,为企业着想,为临床着想,为国家着想,严把产品试验和上市关口。
“如不能坚持科学标准,做不成功药品,也做不出好药。
”论坛中,研发人员、研究者和审评审批部门人员表达了相同的观点。
在没有国际标准可以借鉴的背景下,本维莫德的研发上市能实现领跑国际,整个研发过程各方都秉持着科学和严谨的研发态度,这是产学研和审评审批部门共同努力的结果。
审评审批部门给予企业科学的指导,避免研发走弯路;研究者遵循GCP标准,确保了临床试验数据质量;企业研发者坚持科学标准,以百折不挠的精神克服种种困难,最终实现了本维莫德在中国率先上市。
这是中国学者创新研发、中国监管机构全程交流指导并独立审评审批的全新机制、结构、靶点的药品,中国患者最先享受到中国原创科技成果。
与此同时,本维莫德在中国的研究也为在美国注册上市提供有力支撑,成为中国创新药出海的一个成功典范,科技成果惠及全球银屑病患者。
在谢松梅看来,对于深受难治性皮肤病困扰的患者而言,面临的最大困难莫过于无药可用和无法负担。
药品审评审批制度改革也主要围绕上述两个方向展开,一是鼓励创新,一是促进高质量仿制药或生物类似药研发。
谈及未来的展望,谢松梅表示,未来将持续完善皮肤科药物临床研究技术标准体系,不断培育皮肤科药物创新研发的良好生态,并将与工业界、研究机构共同推进我国药物创新实现新突破。
全国党媒信息公共平台提供信息发布传播服务。
ID:jrtt。